

 |
|
Гранат Ссылки О сайте |

|
Галоидангидриды кислот
Галоидангидриды кислот, продукты замещения гидроксилов кислот галоидами: фтором, хлором, бромом или йодом. Смотря по галоиду, они носят название фтор-, хлор-, бром. или йодангидридов. Можно легко доказать, что эти соединения действительно представляют собою кислоты, один или несколько гидроксилов которых замещены галоидами. Так, один из хлорангидридов, хлорист. сульфурил SO2Cl2, получается прямым соединением двуокиси серы и хлора на солнечном свете:
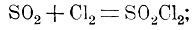
хлорангидрид этот переходит при действии воды в серную кислоту:
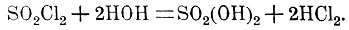
Отсюда ясно, что атомы хлора в частице хлористого сульфурила занимали место гидроксилов частицы серной кислоты.
При действии хлористого водорода на SO3 получ. другой хлорангидрид серной кисл.: SO3+HCl=SO2(OH)Cl, хлористый тионил; при действии воды он дает серную и соляную кислоты:
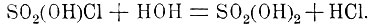
Значить, атом хлора занимал место гидроксила серной кислоты. Этот хлорангидрид, содержа в своей частице кислотный гидроксил, обладает кислотными функциями (его калиевая соль образуется непосредственным соединением серного ангидрида с хлорист. калием: SO3+KCl=SO2(OK)Cl) и называется, поэтому, еще хлоросульфоновой кислотой.
Отношения и свойства хлорангидридов дают полное представление о всем классе Г.
Общий способ получения хлорангидридов кислот состоит в действии пятихлористого или треххлористого фосфора на соответствующую кислоту. Напр., при действии пятихлористого фосфора на безводную серную кислоту получается хлористый сульфурил: H2SO4+2PCl5=2РОCl3+2НCl+SO2Cl2; при действии треххлористого фосфора на уксусную к. получается ее хлорангидрид, хлористый ацетил (хлористый этаноил): 3СН3СООН+РCl3=Р(ОН)3+3СН3СОCl.
Пятихлористый и треххлористый фосфор и РОCl3 (хлороокись фосфора) также представляют собою хлорангидриды кислот, ибо при действии воды дают соответствующую кислоту, замещая свои хлоры на гидроксилы: РCl5+5НOН=5НCl+Р(ОН)5 и далее Р(ОН)5-Н2O=РO(OН)3 (ортофосфорная к.), РCl3+3НОН=3НCl+Р(ОН)3 (фосфористая к.) и РОCl3+3НOН=РO(OН)3+3НCl.
Г. - это смешанные ангидриды. В самом же деле, при действии, напр., на хлористый нитронил (хлорангидрид азотистой кислоты) водой получаются азотистая и соляная кислоты:
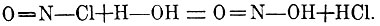
Значит, обратно, отнимая элементы воды от хлорист. водорода и HNO2, мы получим NOCl, их смешанный ангидрид. Отсюда, Г. какой-либо кислоты есть смешанный ангидрид этой кислоты и соляной к. Это особенно хорошо доказывается способом получения хлорангидридов при действии водоотнимающего вещества, фосфорного ангидрида, на смесь данной кислоты с соляной к.:
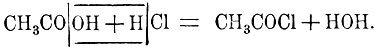
Хлорангидриды представляют собою едкие, летучие, разлагающиеся уже влажностью воздуха, а потому дымящиеся жидкости или (реже) легко сжижаемые газы (как NO2Cl, NOCl, СОСl2). Некоторые из них способны кристаллизоваться. Со спиртами и алкоголятами они дают сложные эфиры: SO2Cl2+2С2Н5ОН=SO2(O.C2H5)2+2HCl; СН3СOСl+NaO.C2H5=CH3COOC2H5+NaCl. С аммиаком они дают амиды кислот.
Органические хлорангидриды восстанавливаются амальгамой натрия с образованием альдегидов и спиртов; с цинк-алкилами они дают, в зависимости от условий, третичные спирты или кетоны. При действии на них цианистого серебра получаются цианиды кислотных радикалов:
Благодаря той легкости, с какой органические хлорангидриды выменивают свой хлор на различные группы, они очень ценятся в лабораторной практике.
Источники:
- Энциклопедический словарь Русского библиографического института Гранат. Том 12/11-е стереотипное издание, до 33-го тома под редакцией проф. Ю. С. Гамбурова, проф. В. Я. Железнова, проф. М. М. Ковалевского, проф. С. А. Муромцева и проф. К. А. Тимирязева- Москва: Русский Библиографический Институт Гранат - 1933.
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://granates.ru/ "Энциклопедический словарь Гранат"